AUTORES:
GUILLERMO CADENAS VACAS(1)
JAVIER SANZ ALONSO (2)
NATALIA MARTÍNEZ RODRÍGUEZ (3)
FERNANDO FERNÁNDEZ CÁLIZ (2) JOSÉ Mª MARTÍNEZ-GONZÁLEZ (4)
- Licenciado en Odontología.Alumno Máster de Cirugía Bucal e Implantología. UCM.
- Profesor Asociado de de Cirugía Bucal. Facultad de Odontología. UCM.
- Profesora del Máster de Cirugía e Implantología. Hospital Virgen de La Paloma. Madrid.
- Profesor Titular de Cirugía Maxilofacial. Facultad de Odontología. UCM. Dirección de correspondencia : jmargo@ucm.es
RESUMEN
La preservación alveolar postextracción se plantea como una alternativa terapéutica dirigida a prevenir el colapso del reborde alveolar, reduciendo su reabsorción tanto en altura como en anchura, mediante el uso de un biomaterial. El presente caso clínico muestra la utilización de un nuevo biomaterial para esta técnica, compuesto por fosfato cálcico con agregado de silicato. Transcurridos tres meses de su colocación, la densidad mineral ósea alcanzada por el biomaterial es óptima para proceder a la rehabilitación implantológica del paciente.
PALABRAS CLAVE
Preservación alveolar, biomateriales, injerto óseo, regeneración ósea guiada, implante dental.
INTRODUCCIÓN
La extracción dental está indicada cuando un diente no puede ser restaurado o conservado en condiciones aceptables para la salud, función y/o estética a largo plazo. Esta pérdida dental tiene un impacto directo en la calidad de vida del paciente ya que afecta a la capacidad masticatoria, el habla y, en algunos casos, a las relaciones sociales1.
La ausencia de un diente en su alvéolo desencadena una cascada de eventos biológicos que dan lugar a significativos cambios anatómicos. Diferentes estudios han demostrado que la pérdida de volumen de la cresta alveolar después de la extracción es un proceso irreversible que implica su reducción en sentido horizontal y vertical1-3. Las consecuencias clínicas de estos cambios fisiológicos, en los tejidos duros y blandos, pueden afectar el resultado de aquellos tratamientos destinados a restaurar la dentición perdida, ya sea limitando la disponibilidad ósea para la colocación ideal del implante o comprometiendo el resultado estético de las restauraciones protésicas3.
La mayor parte de los cambios que sufre un alveolo tras la extracción dental tienen lugar durante los primeros 12 meses. En este periodo se puede observar una reducción del 50% del ancho de la cresta alveolar. Además, dos tercios de esta reducción ocurre durante los primeros tres meses4. Esta tasa de reabsorción ósea, debido a la influencia de una serie de factores locales y sistémicos, varía entre dos individuos e incluso en un mismo individuo en diferentes momentos5.
La preservación alveolar es un procedimiento quirúrgico dirigido a prevenir el colapso del reborde alveolar, preservando su dimensión tras la extracción dental, mediante la utilización de un biomaterial. La finalidad del tratamiento es llevar a cabo una rehabilitación implantológica2,6. El uso de biomateriales de injerto óseo ha demostrado en diferentes estudios proporcionar una estabilidad dimensional a la cresta alveolar reduciendo su reabsorción3,6.
El objetivo del presente caso clínico es presentar un nuevo biomaterial compuesto por fosfato cálcico con agregado de silicato en la técnica de preservación alveolar postextracción.
CASO CLÍNICO
Paciente mujer de 57 años acude al servicio de Cirugía Bucal e Implantología de la Universidad Complutense de Madrid debido a un fuerte dolor en el diente 44 solicitando su extracción y rehabilitación.
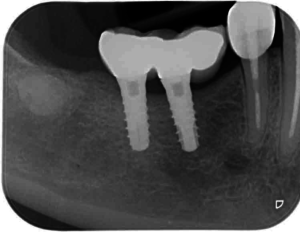
Durante la anamnesis, la paciente no muestra ningún dato relevante, ya que no existe patología sistémica, ni hábito tóxico ni alergia medicamentosa. En la exploración clínica y radiológica se observa la presencia del resto radicular endodonciado del diente 44 (Figuras 1 y 2). El sondaje periodontal revela una fractura vertical radicular.
Se propone la rehabilitación mediante la técnica de preservación alveolar postextracción para prevenir el colapso de la cresta alveolar y reducir su reabsorción hasta la colocación del implante. Como biomaterial de elección se utilizó una cerámica compuesta por fosfato cálcico con agregado de silicato (Osseolive®, Curasan AG, Kleinostheim, Alemania).
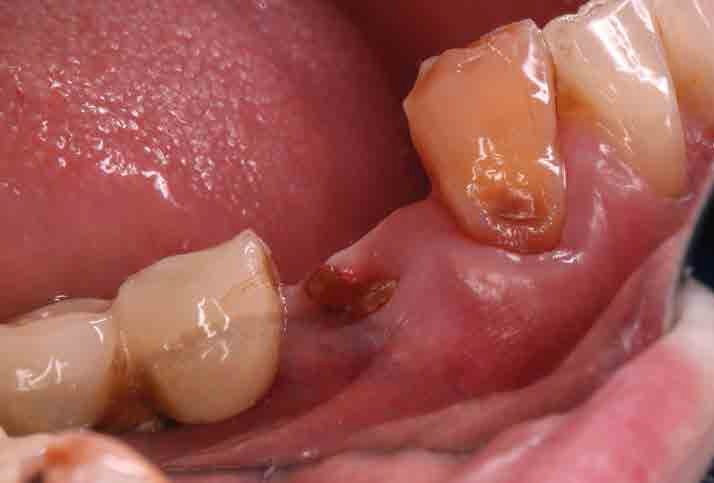
Tras la desinfección del campo quirúrgico con povidona iodada (Betadine®, Meda Pharma SAU, Madrid, España) se procedió, mediante una técnica anestésica infiltrativa supraperióstica, al infiltrado de articaína con epinefrina 40/0,01 mg/ml (Ultracain®, Laboratorios Normon SA, Madrid, España) a nivel vestibular y lingual. A continuación, se realizó la extracción del resto radicular del diente 44 legrando rigurosamente su alveolo (Figura 3).
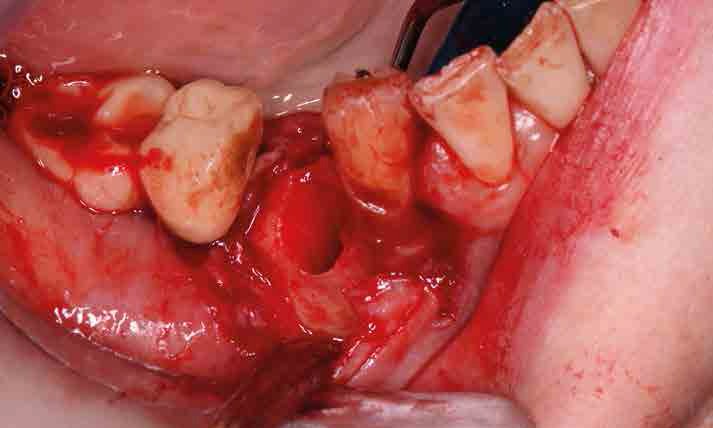
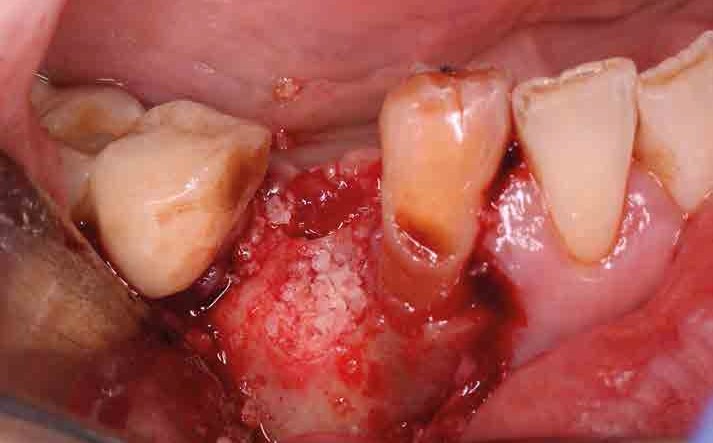
Posteriormente, mediante un colgajo a espesor total se rellenó el alveolo con el biomaterial (Figura 4) y se colocó una membrana de colágeno reabsorbible de 25 x 30 mm de tamaño (Osgide®, Curasan AG, Kleinostheim, Alemania) (Figura 5).
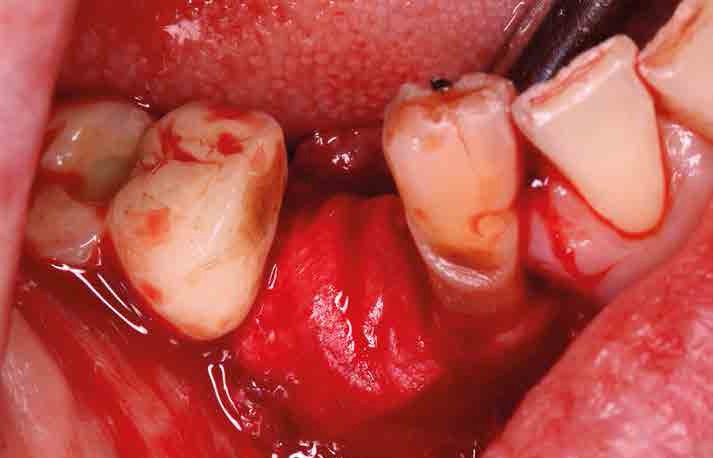
Seguidamente, se procedió al cierre del colgajo mediante la utilización de sutura de cuatro ceros (Figura 6).
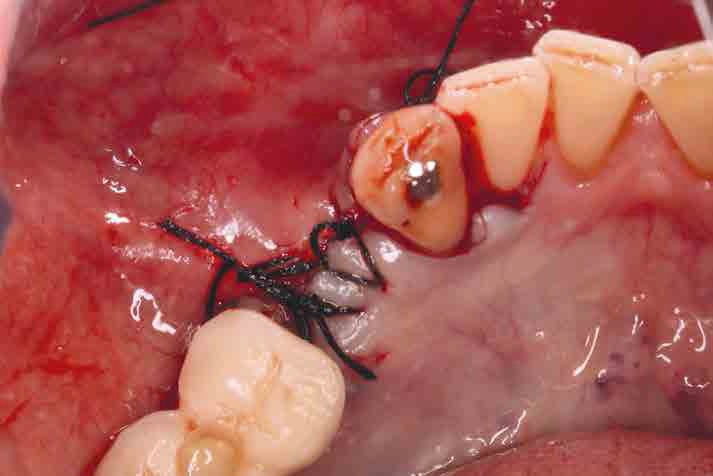
Como medidas postoperatorias se pautó tratamiento antiinflamatorio (diclofenaco sódico 100 mg cada 12 horas durante 4 días) y enjuagues con una solución antiséptica de clorhexidina al 0,12% (Clorhexidina Lacer®, Lacer SA, Barcelona, España). El paciente fue citado a los siete días para la retirada de suturas. Se establecieron citas de revisión durante el primer y segundo mes, realizando radiografías periapicales de control para evaluar una correcta cicatrización de los tejidos.
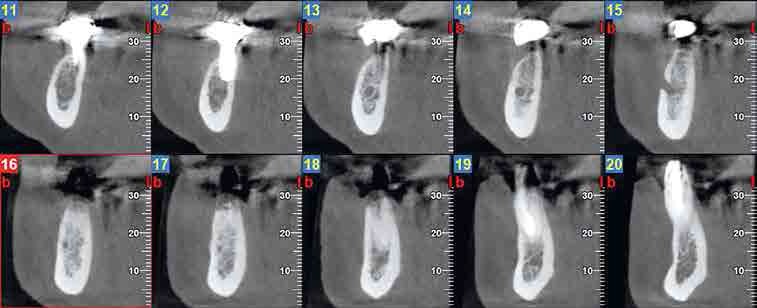
Transcurridos tres meses de la extracción, se realizó una prueba de tomografía computerizada de haz cónico (CBCT) (Newtom modelo 5G XL, Verona, Italia) para valorar la colocación del implante. Esta prueba radiográfica nos aportó la información necesaria para la planificación de la cirugía además de la densidad ósea que presentaba el biomaterial. En este caso se obtuvo una densidad mineral de 1.173,03 unidades Hounsfield (UH) (Figura 7).
Tras realizar una incisión supracrestal y el despegamiento mucoperióstico, se procedió al fresado del lecho implantario siguiendo el protocolo propuesto por la casa comercial y a la colocación de un implante de 4 x 11 mm (OsseoSpeed™ TX, Dentsply Implants Manufacturing GmbH, Mannheim, Alemania) en el espacio disponible entre el agujero mentoniano y el diente 43 con un torque de inserción de 35 Ncm. Una vez comprobada la correcta estabilidad primaria del mismo se colocó el pilar de cicatrización y se suturó la incisión (Figura 8).
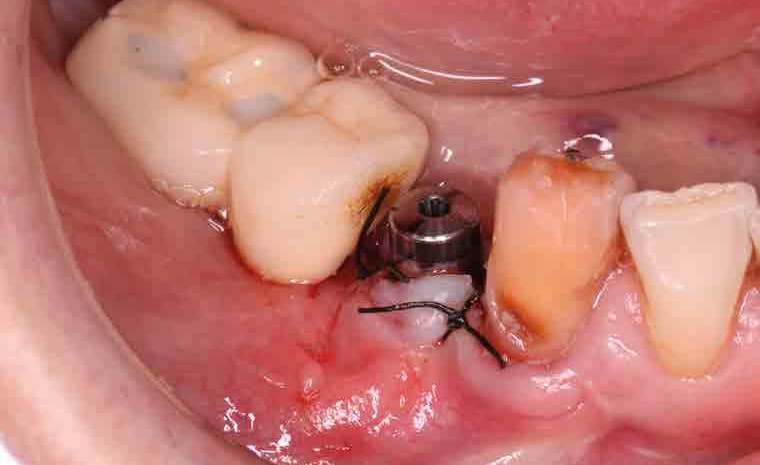
En el postoperatorio se pautó tratamiento antibiótico (amoxicilina 750 mg cada 8 horas durante cuatro días), antiinflamatorio (diclofenaco sódico 100 mg cada 12 horas durante 4 días) y enjuagues con una solución antiséptica (clorhexidina al 0,12%). La paciente fue citada a los siete días para la retirada de puntos y la realización de una radiografía periapical de control (Figura 9).
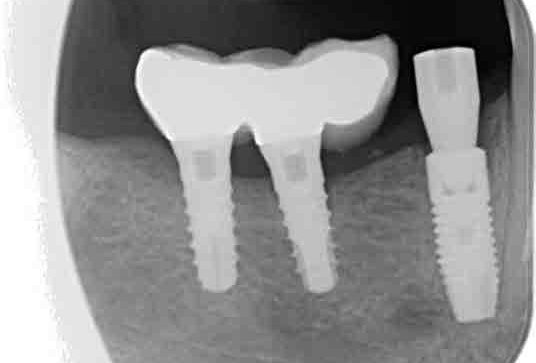
Transcurridos tres meses de la cirugía, se procedió a la carga protésica del implante. Finalmente, se pautaron citas de revisión cada tres meses durante el primer año y posteriormente, cada seis meses para evaluar la correcta cicatrización de los tejidos periimplantarios.
DISCUSIÓN
La regeneración ósea constituye uno de los mayores retos actuales tanto en el campo de la cirugía bucal como en el de la implantología. La instauración de defectos óseos como consecuencia de procesos patológicos supone en numerosas ocasiones un enfoque terapéutico dirigido a la regeneración mediante injertos óseos o biomateriales7,8.
De manera análoga, la pérdida de tejido dentario conlleva de forma irreversible una pérdida de soporte óseo que, en función de factores hereditarios, fisiológicos y mecánicos, comprometen en algunos casos la viabilidad de tratamientos implantológicos convencionales9.
La revisión sistemática realizada por Tan y cols.10, para evaluar los cambios dimensionales que sufre el alveolo tras la extracción dental, revela que después de los seis meses posteriores a la extracción existe una pérdida ósea horizontal del 29% al 63% y una pérdida ósea vertical del 11% al 22%.
El meta-análisis, llevado a cabo por Willenbacher y cols.3, concluye que la realización de preservación alveolar, en comparación con su ausencia, puede reducir esta reabsorción hasta en 1,54 mm en anchura y 1,12 mm en altura durante los seis primeros meses. Por otra parte, la revisión realizada por Horowitz y cols.6 señala una pérdida ósea mayor, siendo esta de 3 mm en anchura y de más de 1 mm en altura. Además, un 20,8% de los alveolos no preservados necesitarán tratamiento mediante injerto óseo adicional para su rehabilitación implantológica, mientras que los alveolos preservados solo lo precisarán un 9,9%3.
En las últimas dos décadas, se han llevado a cabo múltiples estudios que evalúan la eficacia de diferentes materiales de relleno alveolar. En estos estudios, se ha empleado una gran cantidad de biomateriales, entre los que se encuentran el hueso autólogo, aloinjertos, xenoinjertos y aloplásticos, obteniendo cada uno de ellos diferentes resultados clínicos, radiográficos e histológicos1.
En el estudio realizado por Aimetti y cols.11, con un periodo de seguimiento de tres meses sobre 40 pacientes, el grupo test fue tratado con fosfato cálcico, mientras que el grupo control constaba de alveolos vacíos. En estos grupos no se utilizó ningún tipo de membrana. Los resultados obtenidos revelaron que el grupo tratado con biomaterial obtuvo menor reabsorción vertical de la cortical vestibular (0,5 mm frente a 1,2 mm), pérdida de anchura (2 mm frente a 3,2 mm) y, además, una mayor formación de hueso esponjoso (58,8% frente a 47,2%).
En el estudio realizado por Cardaropoli y cols.12 sobre 48 alveolos preservados postextracción, se encontró
una pérdida de anchura entre las corticales a los cuatro meses de 0,71 mm para el grupo tratado con hidroxiapatita bovina y membrana de colágeno, mientras que el grupo control, que consistía en alveolos vacíos, obtuvo una pérdida de 4,04 mm. La pérdida vertical de las corticales fue de 0,58 mm frente a 1,67 mm respectivamente. Resultados similares se encuentran en el estudio de Meloni y cols.13 en el que se observa una pérdida de anchura entre las corticales de 0,67 mm en el grupo tratado con hidroxiapatita bovina y membrana de colágeno.
El uso combinado del biomaterial y la membrana se basa en que la membrana actúa como barrera, impidiendo el crecimiento del tejido blando hacia el interior del alveolo, mientras que el biomaterial evita el colapso de esta estimulando la formación ósea dentro del alveolo. Además, la membrana actúa como hemostático local estabilizando el coagulo sanguíneo14.
En el presente caso clínico el biomaterial de elección para realizar el tratamiento de preservación alveolar postextracción ha sido una cerámica compuesta por fosfato cálcico con agregado de silicato. La incorporación de silicato mejora las propiedades del biomaterial ya que estimula la función de los osteoblastos y la formación de hueso15. Además, diferentes estudios han demostrado que la incorporación de silicato aumenta la angiogénesis favoreciendo la neoformación ósea16,17. Las UH obtenidas en las CBCT ayudan a evaluar la densidad y calidad ósea. Las UH se utilizan para evaluar la densidad radiológica de los materiales y se establecen sobre una base en la que el aire equivale a
<1.000 UH, el agua equivale a 0 UH y el material con mayor densidad equivale a >3.000 UH. La mayoría de las densidades óseas oscilan entre 100 y 1.900 UH18.
En 1999 Misch19 establece una clasificación para poder evaluar la calidad ósea mediante unidades Hounsfield. Esta clasificación, aun vigente, distingue las siguientes densidades óseas:
-
-
- D1: hueso con cortical densa. Presenta >1.250 UH.
- D2: hueso con cortical densa a porosa y trabéculas gruesas. Presenta 850-1.250 UH.
- D3: hueso con cortical porosa delgada y trabéculas finas. Presenta 350-850 UH.
- D4: hueso con trabéculas finas.
- Presenta 150-350 UH.
- D5: hueso con mineralización incompleta. Presenta <150 UH.
-
Los resultados densitométricos, obtenidos en el presente caso clínico, revelan que la densidad mineral del biomaterial a los tres meses es de 1.173,03 UH. Según la clasificación de Misch corresponde a un hueso con densidad tipo dos.
Estos resultados se asemejan a estudios similares como el realizado por Henao y cols.20 en 2016. En este estudio se compara la utilización de dos biomateriales en la técnica de preservación alveolar postextracción. En el grupo test el alveolo se rellenó con beta fosfato tricálcico y en el grupo control se rellenó con un material bifásico dehidroxiapatita sintética y fosfato tricálcico. Utilizaron las UH obtenidas en las CBCT realizadas a los tres meses para evaluar la densidad y calidad ósea de los biomateriales en 37 alveolos, obteniendo una densidad media de 1.052 UH para el grupo que fue tratado con beta fosfato tricálcico y de 1.020 UH para el grupo que es tratado con el material bifásico. Estos autores concluyen que no existen diferencias densitométricas estadísticamente significativas entre un biomaterial y otro.
Sería interesante realizar un análisis histomorfométrico del biomaterial utilizado en el presente caso clínico para poder cuantificar la densidad mineral ósea alcanzada y correlacionarla con los datos densitométricos.
CONCLUSIONES
El uso de biomateriales de injerto óseo, en la técnica de preservación alveolar postextracción, permite reducir la reabsorción de la cresa ósea en altura y en anchura facilitando su posterior rehabilitación implantológica.
En el presente caso clínico la utilización de la cerámica compuesta por fosfato cálcico con agregado de silicato ha mostrado una densidad superior a las 1.000 UH transcurridos tres meses de su colocación. ●
BIBLIOGRAFÍA
- Avila-Ortiz G, Elangovan S, Kramer KW, Blanchette D, Dawson DV. Effect of alveolar ridge preservation after tooth extraction: a systematic review and meta-analysis. J Dent Res 2014; 93 (10): 950-8.
- Vignoletti F, Matesanz P, Rodrigo D, Figuero E, Martin C, Sanz M. Surgical protocols for ridge preservation after tooth extraction. A systematic review. Clin Oral Implants Res 2012; 23 Supl 5: 22-38.
- Willenbacher M, Al-Nawas B, Berres M, Kämmerer PW, Schiegnitz E. The effects of alveolar ridge preservation: A meta- analysis. Clin Implant Dent Relat Res 2016; 18 (6): 1248-68.
- Schropp L, Wenzel A, Kostopoulos L, Karring T. Bone healing and soft tissue contour changes following single-tooth extraction: a clinical and radiographic 12-month prospective study. Int J Periodontics Restorative Dent 2003; 23 (4): 313-23.
- Andrés-Veiga M, Barona-Dorado C, Martínez-González MJ, López-Quiles J, Martínez-González JM. Influence of the patient’s sex, type of dental prosthesis and antagonist on residual bone resorption at the level of the premaxila. Med Oral Pat Oral Cir Buc 2012; 1 (17): 178-82.
- Horowitz R, Holtzclaw D, Rosen PS. A review on alveolar ridge preservation following tooth extraction. J Evid Based Dent Pract 2012; 12 Supl 1: 149-60.
- Arias-Irimia Ó, Barona-Dorado C, Gómez-Moreno G, Brinkmann JC, Martínez-González JM. Pre-operative mea- surement of the volume of bone graft in sinus lifts using compudent. Clin Oral Implants Res 2012; 23 (9): 1070-4.
- López-Quiles J, Garcés R, Trapote S, Paterna E, Cáceres E, Martínez-González JM. Distracción ósea en el maxilar sobre injerto de cresta ilíaca previo y rehabilitación con implantes: a propósito de un caso. Dental Practice 2010; 1 (2): 32-6.
- Knezovic-Zlataric D, Celeriac A, Lazic B. Resorptive changes of maxillary and mandibular bone structures in removable denture wearers. Acta Stomat Croat 2002; 36 (2): 261-5.
- Tan WL, Wong TL, Wong MC, Lang NP. A systematic review of post-extractional alveolar hard and soft tissue dimensional changes in humans. Clin Oral Implants Res 2012; 23 Supl 5: 1-21.
- Aimetti M, Romano F, Griga FB, Godio L. Clinical and his- tologic healing of human extraction sockets filled with calcium sulfate. Int J Oral Maxillofac Implants 2009; 24 (5): 902-9.
- Cardaropoli D, Tamagnone L, Roffredo A, Gaveglio L. Relationship between the buccal bone plate thickness and the healing of postextraction sockets with/without ridge preserva- tion. Int J Periodontics Restorative Dent 2014; 34 (2): 211-7.
- Meloni SM, Tallarico M, Lolli FM, Deledda A, Pisano M, Jovanovic SA. Postextraction socket preservation using epithelial connective tissue graft vs porcine collagen matrix. 1-year results of a randomised controlled trial. Eur J Oral Implantol 2015; 8 (1): 39-48.
- Mardas N, Chadha V, Donos N. Alveolar ridge preservation with guided bone regeneration and a synthetic bone substitute or a bovine-derived xenograft: a randomized, controlled clinical trial. Clin Oral Implants Res 2010; 21 (7): 688-98.
- Pietak AM, Reid JW, Stott MJ, Sayer M. Silicon substitution in the calcium phosphate bioceramics. Biomaterials 2007; 28 (28): 4023-32.
- Zhai W, Lu H, Chen L, Lin X, Huang Y, Dai K y cols. Silicate bioceramics induce angiogenesis during bone regeneration. Acta Biomater 2012; 8 (1): 341-9.
- Alt V, Kögelmaier DV, Lips KS, Witt V, Pacholke S, Heiss C y cols. Assessment of angiogenesis in osseointegration of a silica-collagen biomaterial using 3D-nano-CT. Acta Biomater 2011; 7 (10): 3773-9.
- Jeong KI, Kim SG, Oh JS, Jeong MA. Consideration of various bone quality evaluation methods. Implant Dent 2013; 22 (1): 55-9.
- Misch CE. Contemporary implant dentistry. 2º Ed. St Louis: Mosby; 1999.
- Henao SL, Morales LM, Valencia C, Arce S, Jarami- llo A, Cruz C y cols. Determination of changes in height and bone density after process preservation with synthetic bone substitute. Rev Estomatol 2016; 24 (1): 11-7.